|
|
Resumen.
1. Introducción.
1.1. Enfermedades Parasitarias Ocasionadas por Nematodos.
1.2. Enfermedades Parasitarias Ocasionadas por Cestodos.
1.3. Enfermedades Parasitarias Ocasionadas por Sporozoarios.
2. Toxocariosis de los becerros.
2.1. Síntomas.
2.2. Diagnóstico.
2.3. Tratamiento.
2.4. Antihelmínticos recomendados.
2.5. Control.
3. Dictyocaulosis.
3.1. Ciclos biológicos.
3.2. Efectos patógenos.
3.3. Fase prepatente.
3.4. Fase patente.
3.5. Signos clínicos.
3.6. Diagnóstico.
3.7. Tratamiento.
4. Estrongilosis gastrointestinal.
4.1. Síntomas.
4.2. Diagnóstico.
4.3. Tratamiento.
4.4. Principios generales para un control integrado del Parasitismo Gastrointestinal.
5. Strongyloidosis.
5.1. Síntomas.
5.2. Diagnóstico.
5.3. Tratamiento.
5.4. Profilaxis.
6. Bibliografía.
Resumen.
El presente trabajo incluye las enfermedades parasitarias gastrointestinales y pulmonares de los bovinos, ovinos y caprinos, con especial énfasis en la sintomatología clínica mas característica, así como en los aspectos relacionados con el diagnostico ante mortem y su interpretación. Se suministra información sobre los quimioterápicos de uso más frecuente y sobre estrategias de control bajo un enfoque holístico, básicamente al considerar las afecciones ocasionadas por los estróngilos digestivos, ya que para las otras afecciones parasitarias las recomendaciones sugeridas para la prevención y el control son puntuales.
1. INTRODUCCIÓN.Las enfermedades parasitarias gastrointestinales de los rumiantes son afecciones provocadas por la presencia de helmintos, fundamentalmente nematodos y cestodos y por protozoarios del genero Eimeria.
Entre los helmintos el rol de mayor importancia le corresponde principalmente a los nematodos, tanto por su variedad de especies, así como por la patogenicidad de muchas de ellas y por las asociaciones ínter especificas, todo lo cual es favorecido por su ciclo biológico directo y por la resistencia de los huevos embrionados y de las larvas infestantes (L3) a las condiciones adversas del medio ambiente. En cuanto a los cestodos, que en el caso de los rumiantes en nuestro país incluye básicamente al género Moniezia, su impacto es mas limitado, aunque no por ello debe descuidarse su control ya que cuando sus infestaciones son masivas comprometen incluso la vida de los animales afectados, sobre todo si se trata de animales jóvenes. Aparte de las helmintosis la afección parasitaria del tracto intestinal de mayor importancia es la coccidiosis, cuyos agentes etiológicos responsables pertenecen al genero Eimeria.
1.1. Enfermedades Parasitarias Ocasionadas por Nematodos.
Para denominar a cada una de las enfermedades seguiremos las recomendaciones de la Asociación Mundial para el Avance de la Parasitología veterinaria (W.A.A.V.P siglas en inglés), en su publicación referida a la nomenclatura estandarizada de las enfermedades parasitarias de los animales (Kassai et al,1988) y específicamente nos referiremos a las mencionadas a continuación:
Toxocariosis de los becerros
Dyctiocaulosis
Estrongilosis gastrointestinal
Strongyloidosis
Trichuriosis
1.2. Enfermedades Parasitarias Ocasionadas por Cestodos.
Monieziosis
1.3. Enfermedades Parasitarias Ocasionadas por Sporozoarios.
Coccidiosis intestinal: eimeriosis
2. TOXOCARIOSIS DE LOS BECERROS.
Es una helmintosis provocada por la presencia en el intestino delgado de los becerros (muy raro observar esta parasitosis en los pequeños rumiantes) de nematodos de la familia Ascarididae cuya especie es Toxocara vitulorum. Su presencia esta asociada al periodo o época de partos que es cuando se pueden observar el mayor numero de casos, debido a que las madres se comportan como un hospedador intermediario del parasito y el becerro como un hospedador definitivo. Esto es debido a que si una hembra en edad reproductiva ingiere un huevo larvado de T (Neoascaris) vitulorum, este eclosiona y la larva muda, pero si la hembra que ingirió dicha forma infestante no esta gestante la larva se enquista, pero si dicha hembra esta preñada, las larvas pueden migrar a través de la barrera placentaria y contaminar el feto (eventualidad rara) o bien las larvas migran hacia la glándula mamaria y luego del nacimiento el becerro se contamina al consumir el calostro. Por consiguiente la fuente de infestación mas importante es la leche, ya que las larvas están presentes en la misma por mas de 30 días. Sin embargo. en la región sur del continente africano la ingestión de huevos embrionados infectivos del medio ambiente constituye la ruta de infección mas común. Estas amplias migraciones son muy similares a las de T. canis e hicieron posible su ubicación dentro del género Toxocara. (Anderson, 1992)
2.1. Síntomas.
Los signos clínicos en caso de altas cargas parasitarias están asociados con un pobre desarrollo y diarreas intermitentes, heces fétidas, síntomas neumónicos, además de un aliento en los becerros afectados con olor butírico o a éter.
2.2. Diagnóstico.
Mediante la identificación de las larvas migratorias expulsadas por la boca o por las fosas nasales o de larvas (L2) aisladas del calostro o de la leche de vacas recién paridas o de los parásitos adultos por el ano. Además, la coproscopía siempre y cuando la infestación este en fase patente, es de gran utilidad por ser esta especie muy prolífica y por la características morfológicas de los huevos (Figura 1). También mediante el examen del calostro o de la leche durante los primeros 8 días post parto, mediante una técnica que será descrita al desarrollar los aspectos referentes al diagnostico ante mortem.
Huevo de Toxocara vitulorum

2.3. Tratamiento.
En general, los mismos productos empleados para el tratamiento de los trichostrongílidos son de utilidad para el tratamiento de la toxocariosis en los bovinos (Soulsby, 1982), además las formas adultas son susceptibles a una gran variedad de antihelmínticos, que incluyen piperazina, levamizol y benzamidazoles. Estas drogas son también efectivas contra las formas en desarrollo a nivel intestinal (Urquhart et al ,1999).
2.4. Antihelmínticos recomendados.
Mebendazol:15 mg Kg -1
Febendazol: 7,5 mg Kg -1
Oxbendazol: 4,5 mg Kg -1
Albendazol: 5 mg Kg -1
Levamisol: 7,5 mg Kg -1
2.5. Control.
Se debe evitar que los parásitos afecten a los becerros e impedir la contaminación ambiental con los huevos, para lo cual se deben tratar los becerros entre los 10 y 16 días de nacidos, con el fin de eliminar las formas inmaduras del parasito antes de que ocasionen daño y comiencen la producción de huevos.
3. DICTYOCAULOSIS.
Los parásitos pulmonares se encuentran ampliamente distribuidos en el mundo, pero son muy comunes en países de climas templados y en las zonas montañosas de los países tropicales y sub tropicales. Las especies de importancia en los rumiantes pertenecen a dos familias diferentes; la Dictyocaulidae y la Metastrongylidae. La familia Dictyocaulidae incluye Dictyocaulus viviparus en bovinos y búfalos y Dictyocaulus filaria en ovinos y caprinos, ambas especies se localizan en traquea y bronquios. La familia Metastrongylidae esta representada por al menos tres especies en los pequeños rumiantes: Protostrongylus rufescens, localizado en los bronquiolos, Muellerius capillaris, localizado a nivel de los alvéolos pulmonares y Cystocaulus ocreatus en los bronquiolos terminales.
3.1. Ciclos biológicos.
Las especies de Dictyocaulus tienen un ciclo directo y el comportamiento de sus formas de vida libre es similar al de los trichostrongilos del tracto digestivos. Las larvas infestantes son ingeridas por el hospedador final durante el pastoreo y la larva migra desde el intestino hacia los pulmones vía sistema linfático y circulación pulmonar. Las larvas emergen de los capilares pulmonares, pasan a los alvéolos y migran hacia los bronquios y traquea en donde alcanzan la madurez sexual. El periodo prepotente es aproximadamente de 4 semanas para Dictyocaulus viviparus y de 5 para Dictyocaulus filaria.
En el caso de los Metastrongylidae que afectan a los pequeños rumiantes, sus especies tienen ciclos biológicos indirectos y requieren de caracoles terrestres como hospedadores intermediarios. Su presencia no ha sido reportada en el país.
3.2. Efectos patógenos.
Los efectos patógenos dependen de su localización en el tracto respiratorio, el número de larvas infectantes ingeridas y el estatus inmune del animal.
3.3. Fase prepatente.
Los bronquiolos son bloqueados por el exudado con obstrucción de las vías aéreas, pudiendo ocasionar el colapso de los pulmones.
3.4. Fase patente.
La presencia de los adultos ocasiona bronquitis, enfisema pulmonar, edema e infecciones secundarias como complicaciones secundarias en los casos severos. Después de dos a tres meses la mayor parte de las formas adultas son expulsadas. A pesar de que los animales desarrollan grados variables de inmunidad, en la ausencia de reinfección esta disminuye y los animales se hacen nuevamente susceptibles.
3.5. Signos clínicos.
Tos moderada a severa durante estrés, los animales bajan la cabeza manteniendo el cuello estirado.
3.6. Diagnóstico.
El diagnostico de laboratorio se realiza mediante la coproscopía o mas específicamente mediante la larvoscopia, ya que en los animales afectados por Dictyocaulus, en sus heces se encuentran las larvas, siendo la Técnica de Baermann el procedimiento coproparasitológico de elección. Las larvas de D.viviparus (390 – 450 μ) carecen de botón cefálico, que sí esta presente en D.filaria. (550 – 580 μm).
Larva de Dictyocaulus viviparus
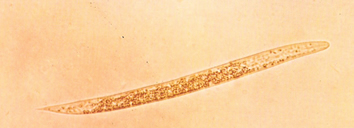
Larva de Dictyocaulus filaria
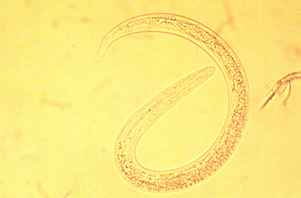
3.7. Tratamiento.
Principios activos utilizados en el tratamiento (dosis y vías de administración en Cuadro 1).
Cuadro I. Antihelmínticos: Vías de administración y espectro de acción
| Nombre genérico | Vía de Administración |
Dosis (mg/Kg.) |
Espectro de actividad |
| Benzimidazoles | |||
| Sulfoxido de Albendazol ** | Sub – cutánea, Oral | 3.75 – 4 7 - 10 |
Nematodos gastroentéricos y cestodos |
| Albendazole | Oral | 5 – 7.5 | Nematodos gastroentéricos, pulmonares y céstodos |
| Cambendazole | Oral | 20- 25 | Nematodos gastroentéricos, pulmonares y céstodos |
| Febantel | Oral | 5 – 10 | Nematodos gastroentéricos, pulmonares |
| Fenbendazole | Oral | 5 – 7.5 | Nematodos gastroentéricos, pulmonares y cestodos |
| Mebendazole | Oral | 12.5 | Nematodos gastroentéricos, pulmonares y cestodos |
| Oxfendazole | Oral/Intra-ruminal | 4.5 – 5 | Nematodos gastroentéricos, pulmonares y cestodos |
| Oxibendazole | Oral | 10 – 15 | Nematodos gastroentéricos |
| Parbendazole | Oral | 20 – 30 | Nematodos gastroentéricos |
| Thiabendazole | Oral | 44 – 110 | Nematodos gastroentéricos |
| Thiofanato | Oral | 50 – 80 | Nematodos gastroentéricos, pulmonares |
| Imidazotiazoles | |||
| Tetramisole | Oral | 15 | Nematodos gastroentéricos y pulmonares |
| Hidroclorido de Levamisole | Oral/Spot-On y sub-cutánea | 7.5 | Nematodos gastroentéricos y pulmonares |
| Fosfato de Levamisol | Ora y sub-cutánea | 8 - 9 | Nematodos gastroentéricos y pulmonares |
| Tetrahidopirimidinas | |||
| Morantel | Oral | 10 | Nematodos gastroentéricos |
| Tartrato de Pirantel | Oral | 25 | Nematodos gastroentéricos |
| Lactonas macrociclicas | |||
| Ivermectina Doramectina | Oral/Spot-On y sub-cutánea | 200 mcg / Kg | Nematodos gastroentéricos y pulmonares |
| Moxidectina | sub-cutánea | 200 mcg / Kg | Nematodos gastroentéricos y pulmonares |
**Bovinos a pastoreo: Adicionar 1,8 Kg de Sulfobendazol en 25 Kg. de sal común o con minerales. Colocar en comederos separados para que los animales puedan consumir dosis medias diarias de 50 g per capita, por un periodo de 2-3 días. Esta cantidad de Sulfoxido de Albendazol provee 7 mg de principio activo por Kg. de peso vivo por día.
Bovinos estabulados: Adicionar 10 mg de Sulfoxido de Albendazol por kg de peso vivo, en la cantidad de ración a ser consumida en un día (dosis única) por los bovinos.
La administración a través de bloques multinutricionales a bovinos a pastoreo ha sido recientemente utilizada con muy buenos resultados.
Benzimidazoles: Albendazole, Cambendazole, Fenbendazole, Mebendazole, Oxfendazole.
Imidazothiazoles: tetramisole, Levamisole Hidroclorido, Levamisol Fosfato.
Lactonas macro cíclicas: Ivermectina.
4. ESTRONGILOSIS GASTROINTESTINAL.
La estróngilosis gastrointestinal o gastroenteritis parasitaria de los rumiantes es debida a la presencia en el cuajo, intestino delgado e intestino grueso de nematodos pertenecientes al orden Strongylida y que a pesar de estar ubicados en diferentes familias, se agrupan todos bajo la denominación de estróngilos digestivos . Los géneros más comunes encontrados en nuestro país pertenecen a la familia Trichostrongylidae (Haemonchus, Mecistocirrus, Trichostrongylus, Cooperia, Ostertagia, Teladorsagia); Ancylostomatidae (Bunostomum, Agriostomum) y Strongylidae (Oesophagostomum), sus ciclos biológicos son bastante similares ya que son directos, es decir no requieren de otros animales para completar sus ciclos vitales, de ahí que la estróngilosis gastrointestinal sea considerada una parasitosis cosmopolita. El desarrollo de las formas de diseminación de los estróngilos digestivos desde la etapa de huevo hasta larva infestante (L3), se desarrolla en el medio exterior y su sobrevivencia es variable y depende en gran medida de las condiciones climáticas.
4.1. Síntomas.
La infestación parasitaria ocasionada por los estróngilos digestivos determina trastornos gastrointestinales con diarrea que conlleva a un estado de desnutrición, anemia y caquexia, cuando los parásitos involucrados y dominantes pertenecen a los géneros Trichostrongylus, Ostertagia, Teladorsagia y Oesophagostomum, porque cuando los géneros numéricamente dominantes son Haemonchus (no hay diarrea) o Mecistocirrus, la anemia es el síntoma sobresaliente. Se trata de una infestación adquirida básicamente en los pastizales que afecta frecuentemente a los animales menores de dos años en el caso de los bovinos y a cualquier edad en los ovinos.
4.2. Diagnóstico.
El diagnostico ante – mortem se realiza mediante el examen coproscópico, a través de la visualización de los huevos y su cantidad, de ahí que sea de gran importancia recurrir a técnicas cuantitativas como las de Wisconsin o de McMaster, pero esta información se debe complementar con la condición corporal (bovinos), valor hematocrito (bovinos, ovinos, caprinos) y presencia o no de diarrea, para hacer una adecuada interpretación de los resultados y seleccionar al interior del rebaño la fracción de animales que requieren tratamiento. En caso de estar interesado en conocer los géneros que están presentes se recurre a la realización de coprocultivos para lograr la evolución de los huevos hasta larva infestante (L3), ya que estas últimas presentan características morfológicas y morfométricas que permiten su diagnostico hasta este nivel.
El diagnostico post – mortem, permite la identificación de las diferentes especies que estén presentes, siempre y cuando se trate de animales recién muertos o cuyos tractos digestivos hayan sido congelados lo antes posible o mantenidos en refrigeración por no mas de 8 horas, ya que la putrefacción además de dificultar las labores, daña los parásitos y se hace muy difícil su identificación precisa.
Huevos de Estróngilos digestivos
4.3. Tratamiento.
El tratamiento de la infestación por estróngilos digestivos requiere en muchos casos la administración de una medicación sintomática a base de antidiarreicos y de tónicos generales. Los antihelmínticos comúnmente utilizados son los siguientes:
Piperazinas: Sales de Piperazina, Dietilcarbamazina.
La piperazina es una droga ampliamente usada contra los ascáridos mientras que la dietilcarbamazina ha sido empleada contra nematodes pulmonares y filarias.
Imidazotiazoles / Tetrahydropyrimidinas: Levamisol y Tetramisol / Morantel, Pirantel.
El Levamisol y el tetramisol son eficaces frente a las formas adultas de los parásitos y en menor escala contra las larvas, son en general muy eficaces contra las estróngilosis gastrointestinales y la mayoría de las debidas a los estróngilos pulmonares como las ocasionadas por el genero Dyctiocaulus, es por ello que cuando se diagnostica una bronconeumonía verminosa constituyen una buena alternativa terapéutica (Levamisol, Tetramisol). En cuanto al Morantel y el Pirantel su rango de eficacia abarca los agentes responsables de la estrongilosis gastrointestinal y a la ascaridosis, pero su acción sobre los Trichostrongylus y Strongyloides es muy irregular. En cuanto a su toxicidad, son bien tolerados y la dosis tóxica es 5 veces superior a la dosis terapéutica en el caso del Pyrantel y 10 veces la dosis terapéutica para el morantel.
Benzimidazoles: Albendazol, Cambendazol, Ciclobendazol, Fenbendazol, Fluobendazol, Luxabendazol, Mebendazol, Oxfendazol, Oxibendazol, Parbendazol, Ricobendazol, Tiabendazol, Triclabendazol.
La mayoría de estos químicos poseen una adecuada actividad frente a los nematodos, excepto el Triclabendazol, cuya actividad especifica es contra formas larvarias y adultas de F. hepatica y es la razón por la cual se comercializa en presentaciones que combinan un antihelmíntico de amplio espectro contra nematodos gastroentéricos con el triclabendazol, en general los antihelmínticos de este grupo poseen una baja toxicidad. La administración de la mayoría de estos antihelmínticos es por vía oral.
Probenzimidazoles: Netobimin, Febantel, Tiofanato.
La metabolización de estos da origen a Bencimidazoles, su mayor efectividad es frente a las formas adultas y algunos presentan una eficacia limitada contra larvas inhibidas, sin embargo otros son buenos larvicidas y ovicidas. Algunos de ellos tienen eficacia contra parásitos bronco pulmonares como Dicyocaulus, nematodos Strongylida tanto adultos como inmaduros (tiofanato), contra nematodos del tubo digestivo y de las vías respiratorias e incluso contra cestodes Anoplocephalidos (febantel), contra nematodos, cestodos y trematodos. (netobimin)
Lactonas macrocíclicas: Avermectinas (Ivermectina, Doramectina) y Milbemicinas. (Moxidectinas)
El grupo de las avermectinas / milbemicinas esta conformado por una serie de lactonas macro cíclicas, que son productos derivados de la fermentación del Streptomyces avermitilis. En general están dotados de una excelente actividad a muy bajas dosis, no solo contra un amplio rango de nematodos sino también contra algunos artrópodos parásitos. Estas drogas pueden permanecer activas por al menos 2 semanas después de su administración debido a su persistencia en la grasa corporal.
Constituyen los antiparasitarios endectocidas por excelencia y permiten una eficaz lucha terapéutica contra nematodos y artrópodos de forma simultánea. Son eficaces frente a diversos nematodos adultos (Haemonchus spp, Oesophagostomum spp etc.), como contra larvas inhibidas y frente a parásitos bronco pulmonares. Son productos de actividad prolongada y existen presentaciones tanto para administración oral como parenteral. Por su eficacia prolongada exigen periodos de retirada más largos que los requeridos por otros antihelmínticos, así tenemos que para las Ivermectinas es de 28 días para la leche y 21 días para la carne. En el caso de la Moxidectina el periodo de supresión para la carne es de 14 días cuando se administra oralmente y 40 días cuando su administración es parenteral y no es recomendable usar la leche de animales tratados con este producto. A continuación suministramos un listado de antihelmínticos en base a sus nombres genéricos, vía de administración, dosis y espectro de actividad. (Hansen y Perry, 1964; Carrillo, 2002)
4.4. Principios generales para un control integrado del Parasitismo Gastrointestinal.
- Adecuado conocimiento de las especies presentes y de su epidemiología, así como la realización periódica de chequeos coproscópicos cuantitativos.
- Se debe evitar la sobre carga del pastizal, ya que esta favorece la tasa de transmisión, debido a que los animales se ven obligados a consumir pasto próximos a la materia fecal y se incrementa el riesgo de consumir elevadas cantidades de larvas infestantes. (L3)
- En vista de que los animales adultos constituyen una fuente de infestación para los jóvenes y que estos últimos son más susceptibles, se debe evitar el pastoreo conjunto.
- Garantizar un buen nivel nutricional de los animales, debido a que de esta manera se mejora la resistencia del hospedador frente a la infestación parasitaria y en general se disminuyen los efectos de la acción de los parásitos gastrointestinales.
- Reconocer y delimitar dentro de la explotación las áreas de mayor riesgo, es decir las ubicadas en lugares que favorecen la retención de agua, ya que las larvas infestantes sobreviven mejor en zonas húmedas que en las secas.
- La rotación de potreros a pesar de ser una medida de control parasitario tradicionalmente recomendada, tiene el problema de que el máximo aprovechamiento y la disminución de los riesgos de infestación para los animales es de difícil implementación debido a la capacidad de sobre vivencia de las larvas infestantes debido a las reservas alimenticias y a la protección contra la desecación brindada por su doble capa cuticular. La alternativa parece ser la implementación de sistemas designados como Pastoreo Rotativo Alterno, en el cual se combina la rotación de los potreros con el uso de especies animales diferentes aprovechando el pastizal en forma discontinua.
- Una adecuada gestión de los pastizales desde el punto de vista del control parasitario debe minimizar el riesgo del consumo de L3 y a la creación de pastizales seguros para el rebaño.
- Se deben emplear antihelmínticos de buena calidad y comprobada eficacia Los mismos deben ser utilizados en forma racional (Selectiva. evitar tratamientos en masa) y evaluados para detectar a tiempo el posible desarrollo de cepas de parásitos quimioresistentes.
- En aquellas fincas en las que se detecte quimioresistencia frente a un principio químico proceder a su rotación y recurrir a productos de composición y mecanismos de acción diferentes.
- Analizar la posibilidad de introducir cepas susceptibles de parásitos con miras a lograr la reversión de la Helmintoresistencia.
- Realizar evaluaciones coproscópicas seriadas de los padrotes a través de su progenie, para de esta manera implementar programas de selección que consideren a la resistencia a la infestación parasitaria, en vista de ser esta un carácter hereditario. Esto implica, además la evaluación comparativa entra razas como entre individuos al interior de una misma raza o cruce. Esta estrategia permite la selección de individuos helmintoresistentes al interior de la raza o la explotación de razas que han incrementado su Helmintoresistencia como producto de la selección natural.
5. STRONGYLOIDOSIS.
La strongyloidosis es una helmintosis debida a la presencia al interior de ulceraciones del epitelio glandular y de la sub mucosa del intestino delgado por nematodos Rhabditidae del genero Strongyloides: S. papillosus. Estos parásitos infestan al hospedador por vía transcutánea principalmente, aunque también lo hacen por vía digestiva, pero en ambos casos, realizan una migración pulmonar antes de instalarse en el intestino delgado, órgano de localización de las hembras adultas partenogenéticas. Es de interés resaltar que las larvas infestantes de Strongyloides papillosus pueden infestar a los recién nacidos con la leche materna.
5.1. Síntomas.
Aunque en generalmente son de poca importancia patológica, bajo ciertas circunstancias pueden ocasionar una severa enteritis, la cual en caso de presentarse se caracteriza clínicamente por síntomas de enteritis aguda catarral, algunas veces hemorrágica, asociados a lesiones cutáneas y respiratorias. Este parasito se encuentra frecuentemente en infestaciones mixtas con los estróngilos gastrointestinales y en becerros con Toxocara vitolorum. Los signos clínicos son usualmente observados en animales jóvenes y son diarrea, anorexia, perdida de peso o disminución en la ganancia del mismo.
5.2. Diagnóstico.
Los signos clínicos antes mencionados conjuntamente con la observación de los huevos característicos (cáscara fina con un embrión formado en su interior) en las heces son indicativos de strongyloidosis. Para el diagnostico coproscópico son de gran utilidad las técnicas cuantitativas de McMaster o de Wisconsin o la cualitativa de Willis.
Huevo larvado de Strongyloides papillosus
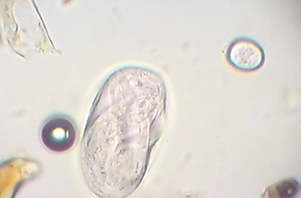
Huevo larvado de estróngilo digestivo
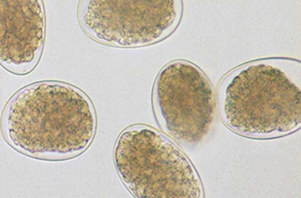
5.3. Tratamiento.
El uso de benzimidazoles o de las lactosas macrocíclicas: avermectinas / milbemicinas son eficaces para el tratamiento de casos clínicos.
5.4. Profilaxis.
El problema de la profilaxis de la strongyloidosis debe enmarcarse bajo el concepto de higiene del sistema de cría, comenzando por el tratamiento de las madres, ya que aunque en ellas la afección se de en forma benigna, al estar parasitadas son la fuente de infección para sus hijos, se debe garantizar la limpieza de los locales de encierro y disponer de abrevaderos limpios, elevados y sin formación de barro en sus alrededores.
6. BIBLIOGRAFÍA.
Bliss, D ; Kvasnicka ,W(1997). The fecal examination: a missing link in food animal practice beef production management. Parasitology, the compendium,.
Egwang, T. y Slocombe, J(1982) J. Evaluation of the Cornell-Wisconsing centrifugal flotation technique for recovering Trichostrongylid eggs from bovine feces. Can. J. Comp. Med. 46: 133-137. 347 pp.
Euzeby , J (1981). Diagnostic experimental des helmintoses animales.Tome 1Informations Techniques des Services Vétérinaires , Ministére de l ´Agriculture , Paris, 349 pp.
F.A.O (2003). Resistencia a los antiparasitarios. Estado actual con énfasis en América Latina .Estudio FAO de Producción y Sanidad Animal 157, Roma ;51 pp.
Goncalves,P.C (1967). Normas para testes a campo con novos anti-helminticos.Brasil. Mimeografiado , 5pp
Graber ,M; Perrotin,C(1983). Helminthes et helminthoses des ruminants domestiques d´Afrique tropicale. Editions du Point Vétérinaire , Maisons Alfort , Francia , 378 pp.
Hansen, J.y Perry, G. (1994). Helminth parasites of ruminants. The epidemiology diagnosis and control of Helminth parasites of ruminants, F:A.O., Nairobi, Kenya, 171 pp.
McKenna, P. (1985). Diagnosis of gastrointestinal nematode parasitism in goats. Foundation for continuing education of the New Zealand Veterinary Association. Proceding of a course in goats husbandry and medicine. Publication N° 106 ; New Zealand , pp. 86- 95
Morales, G. y Pino, L. A. (1977). Manual de diagnóstico helmintológico en rumiantes. Edit. Colegio de Médicos Veterinarios del estado Aragua, Maracay ,Venezuela, 99 pp.
Skerman, K. y Hillard, J. (1966). A handbook for studies of helminth parasites of ruminants. F.A.O., Teherán, 183 pp.
Urquhart ,G.M ; Armour , J ; Duncan , J.L ; Dunn ,A. M , Jennings , F. W.(1999).Veterinary Parasitology. Blackwell Science , U.K , 307 pp.
 página de |
| Colaboraciones |
| Canales |
| Agricultura |
| Ganadería |
| Alimentación |